盐类的水解
以下为《盐类的水解》的无排版文字预览,完整格式请下载
下载前请仔细阅读文字预览以及下方图片预览。图片预览是什么样的,下载的文档就是什么样的。
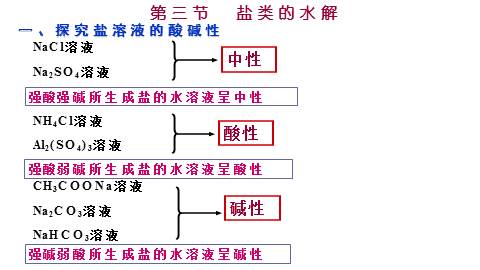
NaCl溶液
Na2SO4溶液
NH4Cl溶液
Al2(SO4)3溶液
CH3COONa溶液
Na2CO3溶液
NaHCO3溶液
强酸强碱所生成盐的水溶液呈中性
强酸弱碱所生成盐的水溶液呈酸性
强碱弱酸所生成盐的水溶液呈碱性
一、探究盐溶液的酸碱性
第三节 盐类的水解
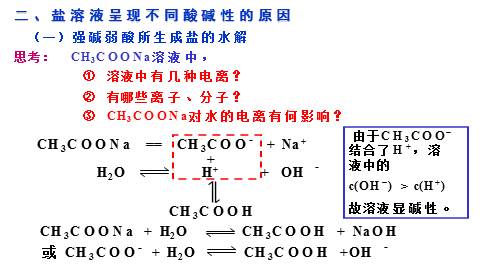
二、盐溶液呈现不同酸碱性的原因
(一)强碱弱酸所生成盐的水解
CH3COONa == CH3COO- + Na+
由于CH3COO- 结合了H+,溶液中的
c(OH-) > c(H+)
故溶液显碱性。
思考:
在溶液中盐电离出来的离子跟水电离
出来的H+或OH-结合生成弱电解质的反应,
叫做盐类的水解。
1、多元弱酸正根离子分步水解,通常以一级水解为主。
注意:
思考:
② 一般盐水解程度较小,生成物中通常不会形成沉淀或气体放出,因此,难溶物不用“↓”气态物不用“↑”,不稳定物也不分解。
2、盐类水解离子方程式的书写
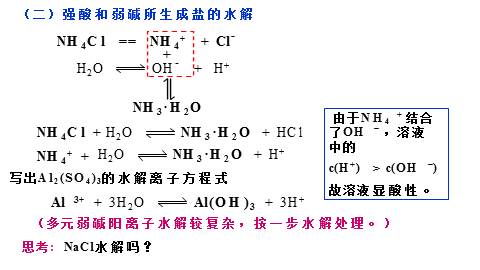
(二)强酸和弱碱所生成盐的水解
NH4Cl == NH4+ + Cl-
由于NH4 + 结合了OH - ,溶液中的
c(H+) > c(OH -)
故溶液显酸性。
写出Al2(SO4)3的水解离子方程式
(多元弱碱阳离子水解较复杂,按一步水解处理。)
思考: NaCl水解吗?
判断下列盐溶液的酸碱性,发生水解的写出水解离子方程式。
NaF 、CuSO4 、KI 、NH4NO3、CsCl 、KHS
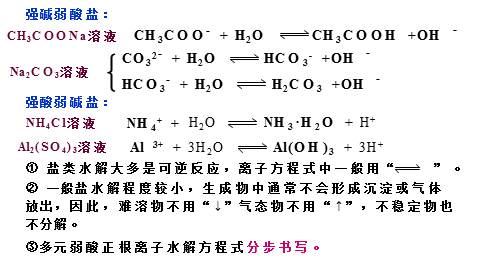
强碱弱酸盐:
强酸弱碱盐:
CH3COONa溶液
Na2CO3溶液
NH4Cl溶液
Al2(SO4)3溶液
② 一般盐水解程度较小,生成物中通常不会形成沉淀或气体放出,因此,难溶物不用“↓”气态物不用“↑”,不稳定物也不分解。
③多元弱酸正根离子水解方程式分步书写。
中和
水解
小结:
② 水解实质:打破水的电离平衡,促进水的电离。
③ 水解规律
有弱才水解,
无弱不水解,
越弱越水解,
谁强显谁性。
思考:已知酸性HF 强于 CH3COOH ,
则等浓度的NaF和CH3COONa溶液谁的pH大?
讨论1:向氨水中加入等浓度的盐酸,要使溶液的pH等于7,
二者的体积的关系如何? V(氨水) V(盐酸)
讨论2:有四种溶液分别为:①pH=0的盐酸; (H+)
②0.1molXXXXXL-1的NaOH溶液; (OH-)
③pH=10的醋酸钠溶液; (OH-)
④pH=5的NH4Cl溶液; (H+)
下列四选项中数据为上述四溶液中水电离的括号中离子浓度大小比,其中符合①∶②∶③∶④的是( )
A、1:10:1010:105 B、1:10:105:1010
C、0:1:10:105 D、1:10:1010:109
二、影响盐类水解的因素
(一)内因:
盐的本性
即形成盐的酸或碱越弱,该盐越容易水解。
讨论1:常温下等浓度的NaX 、NaY、 NaZ pH分别等于7、8、9
试问: HX 、HY、HZ 酸性强弱?全为弱酸吗?
讨论2:比较同浓度Na2CO3与NaHCO3溶液pH大小?
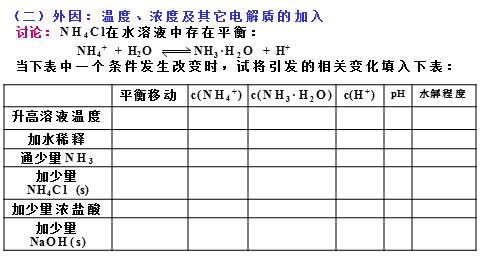
(二)外因:温度、浓度及其它电解质的加入
思考1:向NH4Cl 溶液中加入少量CH3COONa固体,对NH4+ 的水解有何影响?
向CH3COONa 溶液中加入少量NH4Cl固体,对CH3COO- 的水解有何影响?
CH3COONH4溶液中CH3COO-、 NH4+的水解与等浓度CH3COONa 溶液、NH4Cl溶液中对应离子的水解有何区别?
常温,CH3COONH4的pH=?
7
结论1:两弱互促进,谁强显谁性
引申: CH3COONa 溶液中加Na2CO3固体,水解受影响吗?
CH3COO- 、CO32-水解相互抑制。
练习:25℃时,1 mol/L的 (NH4)2SO4、 (NH4)2CO3、
(NH4)2Fe(SO4)2溶液中,测得它们的 c(NH4+) 分别为
a、b、c,下列判断正确的是( )
A、a = b = c B、a > b > c
C、a > c > b D、c > a > b
D
下列离子对在水溶液中因双水解完全而不能大量共存:
Al3+
HCO3-(CO32- )
HS- (S2- )
AlO2-
结论:
注意:双水解的离子方程式用“=”表示,生成沉淀物或气态物
用“↓”或“↑”表示。
讨论:普通泡末灭火器的铁筒里装着一只小玻璃筒,玻璃筒内盛装硫酸铝溶液,铁筒里盛装碳酸氢钠饱和溶液。使用时,倒置灭火器,两种药液相混合就会喷出含二氧化碳的白色泡末。
(1)产生此现象的离子方程式是
__________________________________;
(2)不能把硫酸铝溶液装在铁筒里的主要原因是
_______________________________________;
(3)一般不用碳酸钠代替碳酸氢钠,是因为
________________________________________。
Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑
2Al3+ + 3CO32- + 3H2O = 2Al(OH)3↓+ 3CO2↑
盐类水解规律
强酸弱碱盐:酸性
强碱弱酸盐:碱性
强酸强碱盐:中性
弱酸弱碱盐:酸性、中性、碱性
教材P58
盐的水解常数
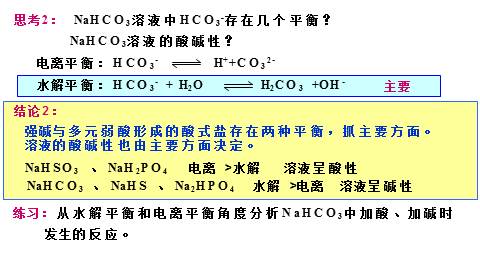
思考2: NaHCO3溶液中HCO3-存在几个平衡?
NaHCO3溶液的酸碱性?
主要
强碱与多元弱酸形成的酸式盐存在两种平衡,抓主要方面。溶液的酸碱性也由主要方面决定。
NaHSO3 、 NaH2PO4 电离 >水解 溶液呈酸性
NaHCO3 、 NaHS 、 Na2HPO4 水解 >电离 溶液呈碱性
练习:从水解平衡和电离平衡角度分析NaHCO3中加酸、加碱时
发生的反应。
结论2:
思考3:等浓度混合的CH3COOH 与 CH3COONa溶液的酸碱性。
因电离 >水解,故混合溶液呈酸性
主要
结论3:存在多种平衡的混合溶液,抓主要方面,溶液的酸碱性也由主要方面决定。
练习:将40mL1mol/L CH3COOH溶液跟40mL 0.5mol/LNaOH溶液相混合,所得溶液中离子浓度由大到小的顺序是( )。
A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(Na+)=c(CH3COO-) > c(OH-) = c(H+)
C.c(CH3COO-)> c(Na+) > c(H+) > c(OH-)
D.c(Na+)> c(OH-)> c(H+)> c(CH3COO-)
该溶液中存在的平衡:
该体系为: 等n的 CH3COOH --- CH3COONa的混合体系
电离 >水解
抓主要方面
C
注意:换成真实的
存在体系!!!
以上二平衡间有何影响?
相互抑制
思考:把AlCl3溶液蒸干,得什么物质?再灼烧,得什么物质?
生成的HCl在加热的过程中挥发,蒸干得到Al(OH)3 ,
再灼烧得 Al2O3 。
四、盐类水解的利用
1、某些盐溶液的配制
如:配制一定浓度的FeCl3、Al2(SO4) 3溶液
引申:若为Al2(SO4) 3溶液呢?
Al2(SO4) 3
2、 除去溶液中某些金属离子
?
讨论:pH=5的MgCl2溶液中,含有FeCl3杂质,为除去杂质加入
的试剂不合理的是( )
A、MgO B、MgCO3 C、NaOH D、Mg2(OH)2CO3
C
3、某些盐的制取
5、化肥施用
如:铵态氮肥不能与草木灰混合施用。
如:制备Al2S3只能在干态
4、某些盐溶液的保存
如: Na2CO3溶液不能用玻璃塞
NH4F不能用玻璃试剂瓶
(例:教材P59 7题)
讨论:为了同时对某农作物施用分别含有N、P、K三种元素的化肥,对于给定的化肥①K2CO3 ②KCl ③Ca(H2PO4)2 ④(NH4)2SO4 ⑤氨水,最适合的组合是( )
A.①③④ B.②③④ C.①③⑤ D.②③⑤
B
思考:把 Mg 投入NH4Cl(CuSO4)溶液中,有何现象?
把CaCO3粉末投入FeCl3溶液中有何现象?
8、Na2CO3溶液可用于清洗油脂,且热的效果较冷的好。
7、泡沫灭火器
6、某些盐(如含Al3+、Fe3+的盐)作净水剂
如:明矾(KAl(SO4)2 XXXXX12H2O)可作净水剂
五、盐类水解的常见题型
(一)判断盐溶液的酸碱性
例:下列物质的水溶液中,所含离子种类最多的溶液是( )。
A.Na2S B.Na3PO4 C.Na2CO3 D.NH4C1
例:浓度均为0.1mol/L的8种溶液:①硝酸?? ②H2SO4??
③CH3COOH?? ④Ba(OH)2??⑤NaOH??⑥CH3COOK?
⑦KCl ?⑧NH4Cl,溶液pH值由小到大的顺序是????? ??? 。
②<①<③<⑧<⑦<⑥<⑤<④
(二)判断盐溶液中离子种类多少
B
(三)判断盐溶液中离子浓度大小
CH3COONa溶液
c(Na+) > c(CH3COO -) > c(OH -) > c(H+)
H3PO4溶液
c(H+) > c(H2PO4 -) > c(HPO4 2- ) > c(PO4 3- )
NaHCO3溶液
c(Na+) > c(HCO3-) > c(OH -) > c(CO32-) /c(H+)
1、多元弱酸及其盐
Na2CO3溶液
c(Na+) > c(CO32-) > c(OH -) c(HCO3-) > c(H+)
—— 抓弱酸的电离平衡
及要水解离子的水解平衡
2、混合溶液
——若要反应,换成现有体系;若不反应,抓主要方面
例:等体积等浓度的MOH强碱溶液与HA弱酸溶液混合后,混合液中有关离子浓度应满足的关系是( )
A.c(M+) > c(OH-) > c(A-) > c(H+)
B.c(M+) > c(A-) > c(H+) > c(OH-) C.c(M+) > c(A-) > c(OH-) > c(H+)
D.c(M+) + c(H+) = c(A-) + c(OH-)
C D
电离为主
NH3XXXXXH2O — NH4+
CH3COOH — CH3COO-
一级水解为主
HCO3- — CO32-
HS- — S 2 -
以下由等n的微粒构成的混合体系存在多种平衡,
抓主要方面。溶液的酸碱性也由主要方面决定。
练习:将0.2 molXXXXXL-1CH3COOK与0.1 molXXXXXL-1盐酸等体积混合后,
溶液中下列微粒的物质的量浓度的关系正确的是( )
A.c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH)
B.c(CH3COO-)=c(Cl-)> c(CH3COOH)> c(H+)
C.c(CH3COO-)> c(Cl-)> c(H+)> c(CH3COOH)
D.c(CH3COO-)> c(Cl-)> c(CH3COOH)> c(H+)
D
浓度最大的离子是?
例、CH3COONa溶液
① 电荷守恒(溶液呈电中性)
c(Na+) + c(H+)= c(CH3COO-)+ c(OH -)
② 物料守恒
(某组分的原始浓度等于它在溶液中各种存在形式浓度之和)
c(Na+) = c(CH3COO-) + c( CH3COOH)
c( OH-) = c(H+ ) + c( CH3COOH)
3、几种守恒
③ 质子守恒
(水电离产生的H+与OH-的各种存在形式的总量相等)
练习:1、 Na2CO3 、 NaHCO3 的几种守恒
2、等浓度的NaOH 和 CH3COOH 混合,
比较 c(CH3COO-)与 c(Na+) 的大小。
① 等体积 ;②混合后pH=7
3、关于0.1 mol/LNa2S水溶液中的
下列关系式,正确的是(? )
①c(Na+) > c(S2-) > c(OH-) > c(HS-) > c(H+) ②c(Na+) + c(H+)=2c(S2-) + c(HS-) +c(OH-) ③c(Na+)=2c(S2-) + 2c(H2S) + 2c(HS-) ④c(OH-)=c(HS-) + c(H+) + 2c(H2S)
A、仅① B、仅①②
C、仅①②③ D、①②③④
D
讨论1:有关①100ml 0.1 mol/LNaHCO3 、
②100ml 0.1 mol/L Na2CO3两种溶液的叙述不正确的是
A.溶液中水电离出的H+个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:
D.②溶液中:
讨论2:室温时,将浓度和体积分别为c1、v1的NaOH溶液
和c2、v2的CH3COOH溶液相混合,下列关于该混合溶液的
叙述错误的是
A.若PH>7时,则一定是c1v1=c2v2
B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.当pH=7时,若V1=V2,则一定是c2>c1
D.若V1=V2,C1=C2,则c(CH3COO-)+C(CH3COOH)=C(Na+)
讨论3:常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:
c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:
c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:
c(Cl-)=c(NH4+) >c(OH-)=c(H+)
D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:
2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
讨论5:室温下,将一元酸HA的溶液和KOH溶液
等体积混合(忽略体积变化),实验数据如下表:
下列判断不正确的是( )
A. 实验①反应后溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B. 实验①反应后溶液中:c(OH—) = c(K+) — c(A—) = mol/L
C.实验②反应后溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
B
1、下列说法正确的是( )
A. 酸式盐的水溶液一定显碱性
B. 只要酸和碱的物质的量浓度和体积分别相等,它们反应后的
溶液就呈中性
C. 纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子
的物质的量浓度相等
D. 碳酸溶液中氢离子的物质的量浓度是碳酸根离子的物质的量
浓度的2倍
C
练习
2、下列叙述正确的是( )
A.pH=3的溶液与pH=11的溶液混合后pH值不一定等于7
B.同浓度的Na2CO3溶液室温时的pH值必定大于60℃的pH值
C.同浓度的钾盐溶液,酸式盐的pH值必定小于对应正盐的pH值
D.因为碳酸的酸性比亚硫酸弱,所以室温下同浓度的碳酸钠
溶液的pH值小于亚硫酸钠溶液pH值。
A C
3.有pH值相等的A、B、C、D四种
一元酸的溶液各20mL,与过量镁充分
反应后,产生氢气质量是D>C>B=A。
这说明:①D的酸性最强。②A与B的
酸性最强且彼此相当。③原D反应后溶
液的pH值最大。④反应后原A和B的溶
液的pH值最大 >>>>>>内容过长,仅展示头部和尾部部分文字预览,全文请查看图片预览。<<<<<< L-1。两者关系为( )
A.相等 B.x>y C.x=10-2y D.x=102y
C
8、已知25℃时0.01molXXXXXL-1醋酸溶液的
pH约为3。向其中加入少量醋酸钠晶体,
等晶体溶解后发现溶液的pH增大。对上
述现象有两种不同的解释:甲同学认为
醋酸钠水解呈碱性,增大了c(OH-),因而
溶液的pH增大;乙同学认为醋酸钠溶于
水电离出大量醋酸根离子,抑制了醋酸
的电离,使 c(H+) 减小,因此溶液的pH增大,你认为上述两种
解释中 正确(填“甲”或“乙”)
(1) 为了验证上述哪种解释正确,继续做如下实验,向
0.01mol/L的醋酸溶液中加入少量下列物质,然后测定溶液的pH
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(2) 若 (填“甲”或“乙”)的解释正确,溶液的pH应______
(填“增大”、“减小”或“不变”。)
(已知:25℃时0.01mol/L的氨水和醋酸的电离程度相同)[文章尾部最后500字内容到此结束,中间部分内容请查看底下的图片预览]
以上为《盐类的水解》的无排版文字预览,完整格式请下载
下载前请仔细阅读上面文字预览以及下方图片预览。图片预览是什么样的,下载的文档就是什么样的。
图片预览