化学专题复习--------离子反应复习
以下为《化学专题复习--------离子反应复习》的无排版文字预览,完整格式请下载
下载前请仔细阅读文字预览以及下方图片预览。图片预览是什么样的,下载的文档就是什么样的。
离子方程式复习
会考知识点:
电解质.非电解质的概念
强弱电解质,电解质的电离方程式
离子反应的本质和发生条件
离子方程式
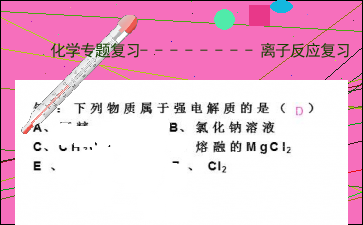
例1:下列物质属于强电解质的是( )
A、酒精 B、氯化钠溶液
C、CH3COOH D、熔融的MgCl2
E 、Cu F 、 Cl2
D
化合物——>
是否
电离
电解质
非电解质
{
强电解质
弱电解质
{
{
强酸
强碱
大多数盐
弱酸
弱碱
水
{
电离
程度
___>
强电解质
1.强酸:H2SO4、HNO3 、 HCl等
2.强碱:NaOH、KOH、Ba(OH)2等
3.大多数盐(包含难溶性盐):与溶解度无关
K+,Na+,NH4+,NO3-,HCO3-均可溶
Cl- 除AgCl外 , 可溶
难溶性盐:BaSO4、Ag2SO4、CaSO4
{
可溶性盐
{
弱电解质
1.弱酸: H2CO3,HClO,CH3COOH等
2.弱碱: 不溶性碱如:Cu(OH)2,Mg(OH)2;
和氨水 NH3.H2O
3.H2O
写出下列物质的电离方程式:
NaHCO3
KClO3
Ba(OH)2
H2O
练习
下列物质中是电解质的是:______________
是非电解质的是________________。
① NH3XXXXXH2O ② NaOH ③ NaHCO3
④ C12H22O11 (蔗糖) ⑤ H2SO4 溶液
⑥ HCl (氯化氢)⑦铁⑧ SO2
①②③⑥
④ ⑧
一:离子反应
(1)概念:
(2)意义:
在水溶液中(或熔融状态)有离子参加或生成的反应
如: H+ +OH- =H2O
不仅能表示一定物质间的反应,还可表示同一类物质的反应
(3)离子反应发生的条件
1) 生成难溶物质,如 AgCl、BaSO4 、Cu(OH)2、CaCO3
Na2CO3 + CaCl2 = CaCO3 + 2NaCl
CO32- + Ca2+ = CaCO3
3)生成难电离的物质,
H2SO4 + 2NaOH = Na2SO4 + 2H2O
H+ + OH- = H2O
2) 生成挥发性的物质,如 CO2 、H2S、SO2
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
CO32- + 2H+ = H2O + CO2
如弱酸、弱碱、水等。
(4)离子方程式:用实际参加反应的离子符号表示化学反应的式子
书写方法:1、写---写出化学方程式
2、拆---把易溶于水、易电离的物质拆写成离子的形式
3、删---将不参加反应的离子从方程式两端删去
4、查---原子个数、电荷数是否相等
例1:硫酸铵与氢氧化钡溶液共热
拆----易溶于水,易电离的物质
即易溶于水的强电解质:
强酸,强碱,可溶性盐
书写下列离子反应方程式:
1.澄清石灰水与稀盐酸反应
2.钠与水的反应
3.大理石溶于醋酸
4.碳酸氢钠溶液中加NaHSO4
练习:热水瓶使用一段时间后,瓶胆内壁会形成水垢(组成为碳酸钙、氢氧化镁),水垢可用稀盐酸、醋酸来溶解而除去。请写出其反应的离子方程式。
用盐酸:
CaCO3+2H+=Ca2++H2O+CO2↑
Mg(OH)2+2H+=Mg2++2HO2
用醋酸:
CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
Mg(OH)2+2CH3COOH=Mg2++2CH3COO-+2H2O
胃酸中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水。服用适量的小苏打,能治疗胃酸过多,请写出小苏打能和盐酸发生离子反应:
如果病人同时患胃溃疡,为防止胃穿孔,此时最好用含氢氧化铝的胃药(如胃舒平),写出这一反应的离子方程式为:
练习
HCO3-+H+=H2O+CO2↑
Al(OH)3+3H+=Al3++3H2O
如 Ca(OH)2+2NH4Cl = CaCl2+2NH3↑+2H2O
△
熟石灰
氯化铵
注意事项:
1.固体间的反应一般不写离子反应方程式;
2反应中的微溶物:反应物处于溶液中时写成离子形式,处于浊液写成化学式。
例:向石灰乳中加入稀硫酸
如条件是澄清的石灰水,则应拆;若给的是石灰乳则不能拆。
3.铵盐与碱的反应,条件不同,离子方程式写法不同。
NH4Cl与NaOH 稀溶液,不加热反应
NH4++OH-=NH3.H2O
NH4Cl与NaOH浓溶液或加热反应
NH4++OH- = NH3↑+H2O
△
4.反应物的量不同,离子方程式也会不同。
【例】完成下列离子反应方程式
1.向氢氧化钙溶液中加入少量的CO2气体
2.向氢氧化钙溶液中加入过量的CO2气体
CO2+Ca2++2OH-= CaCO3 +H2O
CO2+OH-= HCO3-
↓
下列离子方程式正确的是( )
A、铁与稀硫酸
2Fe + 6H+ = 2Fe3+ + 3H2
B、硫酸和Ba(OH)2的反应
SO42- + Ba2+ =BaSO4
C、铜与硝酸银溶液
Cu + Ag+ = Cu2+ + Ag
D、硫酸铵与氢氧化钠溶液共热
NH4+ +OH- =NH3 +H2O
↑
↓
↑
?
D
下列离子方程式正确的是:( )
A、烧碱与碳酸氢钠溶液的反应
HCO3-+OH- =CO32-+H2O
B、碳酸钙受热分解的 离子方程式:
CaCO3= CaO+ CO2
C 、 Cl2通入石灰乳中
Cl2+2OH-=Cl-+ClO-+H2O
D、铁片插入氯化铁溶液中
Fe + Fe3+ =2Fe2+
?
↑
A
小结:离子方程式书写:
1、是否符合事实
2、分清拆与不拆
质量是否守恒,
电荷是否守恒,
得失电子是否相等
{
3.查--
(5)离子共存
(找离子之间的反应)
判断下列各组离子能否大量共存
① Ca2+ Na+ CO32- NO3-
② Ca2+ Na+ SO42- NO3-
③ H+ K+ Cl- OH-
④ NH4+ K+ OH- SO42-
⑤ H+ K+ HCO3- SO42-
⑥ Na+ K+ CO32- OH-
生成难溶物 CaCO3
生成微溶物 CaSO4
生成水
生成NH3XXXXXH2O
生成弱酸 H2CO3
能大量共存
离子不共存情况:
⑴生成难溶物或微溶物:
如:Ba2+与CO32-、Ag+与Cl-、
Ca2+与SO42-等
⑵生成气体或挥发性物质:
如: OH-与NH4+ 、
H+与CO32-、HCO3- S2-、SO32-等
⑶生成难电离物质:
如:H+与Ac-、ClO-、等生
成弱酸;
OH-与NH4+生成的弱碱;
OH-与HCO3-生成水
H+与OH-生成水
(4)发生氧化还原反应而不共存:
如:2Fe3++Cu=2Fe2+ +Cu2+
Fe3++I- =Fe2+ + I2
在强碱性溶液中能大量共存并且无色透明的离子组合( ) A Na+ NH4+ NO3- Cl-
B K+ CO32- Na+ NO3-
C Ca2+ Ba2+ HCO3- Cl-
D MnO4- SO42- K+ Na+
B
3、在溶液中能大量共存,若加入OH-就有沉淀析出,若加入H+就能放出气体的是( )
A、Mg2+、Na+、Cl-、CO32-
B、Ba2+、K+、OH-、NO3-
C、H+、SiO32-、NH4+、SO42-
D、Na+、Ca2+、Cl-、HCO3-
D
离子反应的本质:
反应物的某些离子浓度减小
在碎蛋壳上滴上稀盐酸,会产生一种使澄清石灰水变浑浊的无色气体,可推知蛋壳可能含有___________;并写出上述两个反应的离子方程式_______________________________
CaCO3
写出下列反应的离子方程式:
(1)用稀硫酸清洗铁锈(Fe2O3)
(2)碳酸氢钠溶液与盐酸混合
(3)向足量澄清石灰水中通入二氧化碳
(4)硫酸铵与氢氧化钠溶液共热
(5)氢氧化铜和稀盐酸反应
(6)碳酸钠溶液与醋酸反应
(7) 石灰石溶于硝酸
(8) 将钠块投入水中
(9)将氯气通入溴化钠溶液
(10)氯化铝溶液中滴入氨水
(11)铜粉投入硝酸银溶液中
(12)将氯气通入氯化亚铁溶液中
(13)铜粉投入氯化铁溶液中
(14)氯化铵溶液中加入NaOH并加热[全文已结束,注意以上仅为全文的文字预览,不包含图片和表格以及排版]
以上为《化学专题复习--------离子反应复习》的无排版文字预览,完整格式请下载
下载前请仔细阅读上面文字预览以及下方图片预览。图片预览是什么样的,下载的文档就是什么样的。
图片预览