《化学工艺流程题复习指导》教学课件共25张PPT
以下为《《化学工艺流程题复习指导》教学课件共25张PPT》的无排版文字预览,完整格式请下载
下载前请仔细阅读文字预览以及下方图片预览。图片预览是什么样的,下载的文档就是什么样的。
化学工艺流程题复习指导
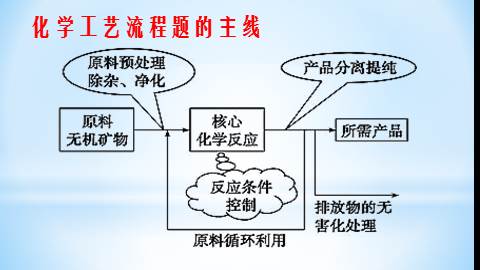
化学工艺流程题的主线
(一)生产条件的控制
1、原料的预处理
①溶解
②灼烧
③煅烧
④研磨
⑤煮沸
2、控制反应条件的方法
外界条件对化学反应速率的影响
外界条件对化学平衡转化率的影响
(一)生产条件的控制
(一)生产条件的控制
例:硝酸生产中,500℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0 K=1.1XXXXX1026
②4NH3(g)+4O2(g) 2N2O(g)+6H2O(g) △H<0 K=4.4XXXXX1028
③4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H<0 K=7.1XXXXX1034
其中,②、③是副反应。若要减少副反应,提高NO的产率,最合理的措施是( )
A.减小压强 B.降低温度 C.增大O2浓度 D.使用合适的催化剂
D
(一)生产条件的控制
2、控制反应条件的方法
①使用合适的催化剂
②适当升温或降温
③适当加压或减压
④选择合适的投料比
【思考】工业上要提高合成氨的生产效益,应如何选择生产条件?
①使用催化剂:增大化学反应速率
②合适的温度:500℃左右
合成氨催化剂的活性温度,提高反应速率;
③合适的压强:20MPa~50MPa,提高反应物的转化率
④合适的投料比:原料气中N2、H2体积比约为1:2.8
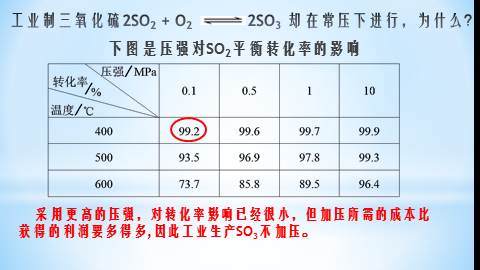
工业制三氧化硫2SO2 + O2 2SO3 却在常压下进行,为什么?
下图是压强对SO2平衡转化率的影响
采用更高的压强,对转化率影响已经很小,但加压所需的成本比获得的利润要多得多,因此工业生产SO3不加压。
(一)生产条件的控制
2、控制反应条件的方法
①使用合适的催化剂
②适当升温或降温
③适当加压或减压
④合适的投料比
⑤反应时的气体氛围
⑥原料的加入方式
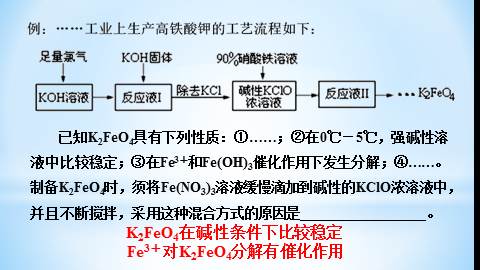
K2FeO4在碱性条件下比较稳定
已知K2FeO4具有下列性质:①XXXXXXXXXX;②在0℃-5℃,强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④XXXXXXXXXX。
制备K2FeO4时,须将Fe(NO3)3溶液缓慢滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是__________________。
Fe3+对K2FeO4分解有催化作用
(一)生产条件的控制
2、控制反应条件的方法
①使用合适的催化剂
②适当升温或降温
③适当加压或减压
④合适的投料比
⑤反应时的气体氛围
⑥原料的加入方式
⑦根据题目提供的图像信息推断反应的适宜条件
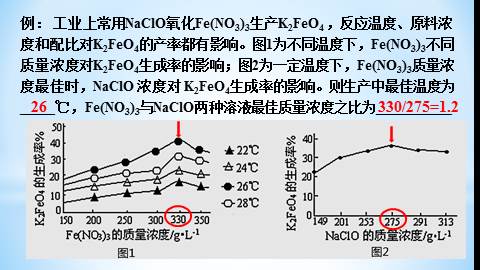
例: 工业上常用NaClO氧化Fe(NO3)3生产K2FeO4 ,反应温度、原料浓度和配比对K2FeO4的产率都有影响。图1为不同温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO 浓度对 K2FeO4生成率的影响。则生产中最佳温度为_____℃,Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为___________
26
330/275=1.2
(二)核心化学反应的推断
特别关注:
氧化还原反应及元素化合价的变化
溶液的酸碱性
各阶段主要元素的存在形式
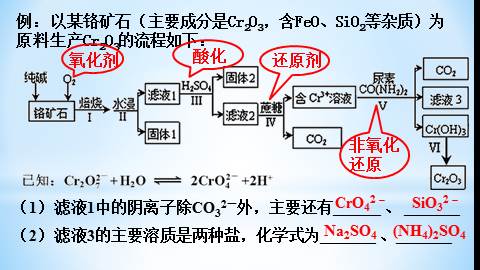
(1)滤液1中的阴离子除CO32-外,主要还有______ 、 _______
(2)滤液3的主要溶质是两种盐,化学式为_______ 、_______
例:以某铬矿石(主要成分是Cr2O3,含FeO、SiO2等杂质)为
原料生产Cr2O3的流程如下:
CrO42-
SiO32-
Na2SO4
(NH4)2SO4
酸化
氧化剂
还原剂
非氧化
还原
(三)产品的分离提纯
1、物质的分离和提纯的常用方法:
①结晶或重结晶:重结晶可以使不纯净的固体物质获得纯化。
②过滤
③蒸馏
④分液
⑤萃取或反萃取:反萃取是利用反萃取剂使被萃取物从负载有机相返回水相的过程,为萃取的逆过程。
⑥升华
⑦盐析
(三)产品的分离提纯
2、利用控制pH分离除杂;
例如:如何除去Cu2+溶液中混有的Fe3+?
可加入CuO、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH值 ,促进Fe3+的水解平衡正移。
调节pH所需的物质一般应满足两点:
①能与H+反应,使溶液pH值增大
②不引入新杂质
(三)产品的分离提纯
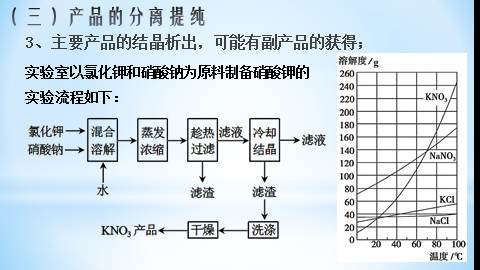
3、主要产品的结晶析出,可能有副产品的获得;
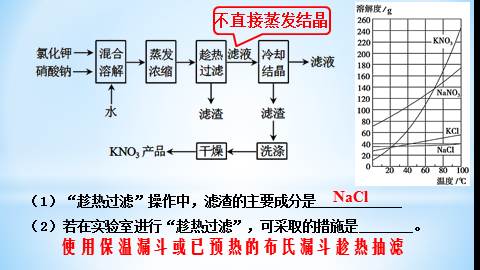
实验室以氯化钾和硝酸钠为原料制备硝酸钾的实验流程如下:
(1)“趁热过滤”操作中,滤渣的主要成分是____________
(2)若在实验室进行“趁热过滤”,可采取的措施是 。
NaCl
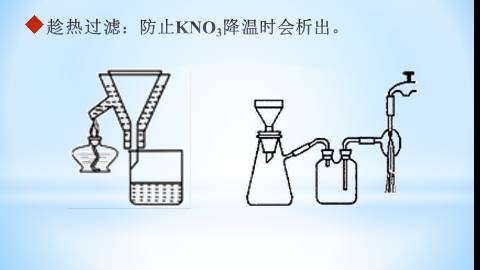
不直接蒸发结晶
使用保温漏斗或已预热的布氏漏斗趁热抽滤
趁热过滤:防止KNO3降温时会析出。
(三)产品的分离提纯
4、产品的洗涤提纯:
可以洗去晶体表面的杂质离子
减少晶体在洗涤过程中的溶解损耗
已知K2FeO4具有下列性质:①可溶于水,微溶于KOH溶液,难溶于异丙醇;②在0℃-5℃,强碱性溶液中比较稳定;③XXXXXXXXXX;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
请完成关于K2FeO4粗产品纯化的实验步骤:
(可选用的试剂:NaOH溶液、KOH溶液、蒸馏水和异丙醇)
①将K2FeO4粗产品溶解在__________中,再次在冰水浴中静置结晶后过滤,得到较纯净的K2FeO4;
②将K2FeO4晶体再用少量__________洗涤,低温真空干燥,得到高铁酸钾成品。
异丙醇
(四)原料的循环再利用
1、从流程中需要加入的物质去找:
(四)原料的循环再利用
2、从能构成可逆反应的物质去找:
(四)原料的循环再利用
1、从流程需要加入的物质去找:
2、从能构成可逆反应的物质去找:
3、从过滤后的母液中寻找:
析出晶体经过滤后的液体为母液,母液是该晶体溶质的饱和溶液,应该循环再利用。
化学工艺流程题的核心考点:
生产条件的控制
核心化学反应的推断
产品的分离提纯
原料的循环利用
[全文已结束,注意以上仅为全文的文字预览,不包含图片和表格以及排版]
以上为《《化学工艺流程题复习指导》教学课件共25张PPT》的无排版文字预览,完整格式请下载
下载前请仔细阅读上面文字预览以及下方图片预览。图片预览是什么样的,下载的文档就是什么样的。
图片预览