1-1-1-7电解质和非电解质
以下为《1-1-1-7电解质和非电解质》的无排版文字预览,完整格式请下载
下载前请仔细阅读文字预览以及下方图片预览。图片预览是什么样的,下载的文档就是什么样的。
第二节 电解质
一、电解质及其电离
下列物质哪些可以导电?
食盐水溶液、砂糖水溶液、盐酸、
NaOH溶液、乙醇、食用醋、菜籽油
可以导电的有:
食盐水溶液、盐酸、 NaOH溶液、食用醋
不能导电的有:
砂糖水溶液、乙醇、菜籽油
实验还证明:
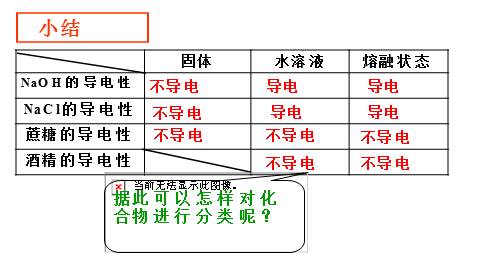
⑴NaCl、NaOH、蔗糖固体均不导电,将 NaCl 、NaOH加热至融化(熔融状态)它们可以导电;
⑵ 将蔗糖加热至融化(熔融状态)蔗糖不导电。
不导电
导电
导电
不导电
导电
导电
不导电
不导电
不导电
不导电
不导电
小结
据此可以怎样对化合物进行分类呢?
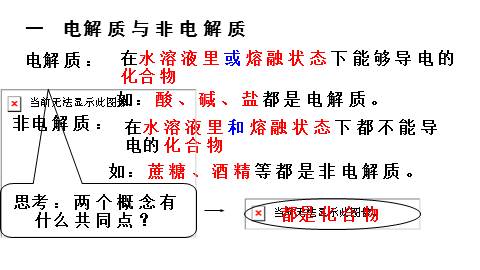
电解质:
在水溶液里或熔融状态下能够导电的化合物
非电解质:
在水溶液里和熔融状态下都不能导电的化合物
一 电解质与非电解质
如:酸、碱、盐都是电解质。
如:蔗糖、酒精等都是非电解质。
思考:两个概念有什么共同点?
都是化合物
①硝酸钾溶液能导电,所以硝酸钾溶液是电解质。
②铜、石墨均能导电,所以它们是电解质。
③在熔融状态和水溶液中都能导电的化合物才是电解质。
④蔗糖、酒精在水溶液或融化状态下均不导电,所以它们是非电解质。
⑤ 能够导电的物质一定是电解质。
XXXXX
XXXXX
XXXXX
XXXXX
√
【思考讨论1】
思考讨论 2
铜丝经常用做导线,分析铜线导电的原因?
铜丝内部存在自由移动的电子; 在外加电场的作用下,电子定向移动,形成电流。
物质导电必须具备什么条件?
有自由移动的带电微粒(可以是电子或离子)。
思考讨论 3
为何NaCl固体不导电?是NaCl固体内部没有带电荷的微粒吗 ?
固体NaCl没有自由移动的离子。NaCl固体中有阴、阳离子,但没有自由移动的离子。
NaCl溶液、熔融的NaCl为什么能够导电?
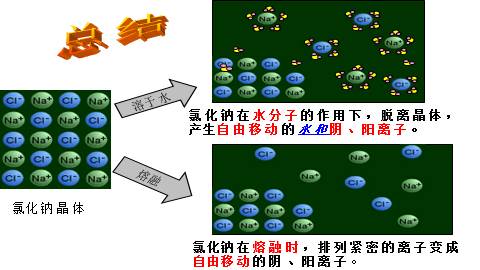
NaCl晶体溶解于某某,Na+和Cl-就会逐渐脱离晶体表面而进入溶液,成为自由移动的阴、阳离子。
固体NaCl受热融化时, 氯化钠晶体中原来排列紧密的Na+?、Cl- 也能成为自由移动的离子。
溶于某某
熔融
氯化钠晶体
氯化钠在水分子的作用下,脱离晶体,产生自由移动的水和阴、阳离子。
氯化钠在熔融时,排列紧密的离子变成自由移动的阴、阳离子。
总结
2、 电解质的电离
物质溶于某某或受热熔化时,离解成自由移动的离子的过程称为电离。
(1)电离:
思考:电离的条件是什么?
电离需不需要通电?
电离的结果是什么?
酸的电离条件是什么?
盐、碱的电离条件是什么?
水溶液或熔融状态
电离不需要通电
产生能自由移动的离子
在溶于某某和熔融时均能发生电离。
只在溶于某某时
Na2SO4
例:
电离方程式的书写
NaCl
NaOH
KNO3
注意
电离过程,原子团不能拆
遵守原子个数守恒、电荷守恒
= Na+ + Cl-
= Na+ + OH-
= K+ + NO3-
= 2Na+ + SO42-
(2)电离的表示方法
1、下列电离方程式中,错误的是( )
A. Al2(SO4)3 = 2Al+3 + 3SO4-2
B. FeCl3 = Fe3+ + Cl3-
C. HCl = H+ + Cl-
D. Na2CO3 = Na+ + CO32-
ABD
课堂练习1
书写下列物质的电离方程式
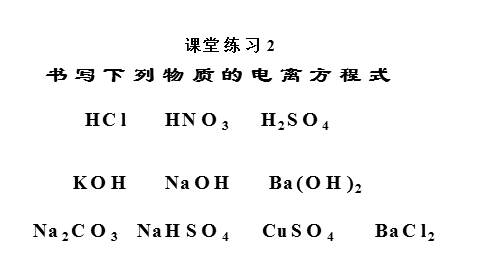
HNO3
HCl
H2SO4
KOH
Ba(OH)2
NaOH
Na2CO3 NaHSO4 CuSO4 BaCl2
课堂练习2
【应用】:你可以给酸、碱、盐下个定义吗?
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4= 2H+ + SO42-
KOH = K+ + OH-
Ba(OH)2 = Ba2+ + 2OH-
NaOH = Na+ + OH-
Na2CO3
(NH4)2SO4
BaCl2
= 2Na+ + CO32-
= 2NH4+ + SO42-
= Ba2+ + 2Cl-
CuSO4=Cu2++ SO42-
不一定
NaHSO4= Na+ + H++ SO42-
【思考】
电离出氢离子的电解质一定是酸吗?
【练习】下列物质:①氯化氢 ②氢氧化钙 ③次氯酸钠 ④二氧化硫 ⑤二氧化碳 ⑥铜 ⑦石墨 ⑧石灰水 ⑨硫酸 ,其中属于电解质的是 ,属于非电解质的是 。
①②③⑨
④⑤
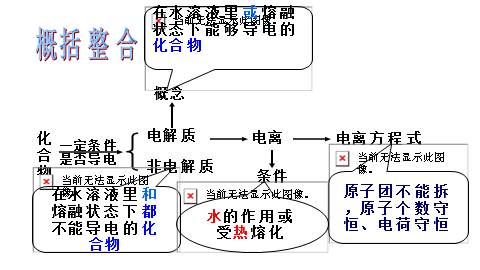
化
合
物
概念
电离
电离方程式
电解质
非电解质
概括整合
在水溶液里或熔融状态下能够导电的化合物
在水溶液里和熔融状态下都不能导电的化合物
原子团不能拆,原子个数守恒、电荷守恒
条件
水的作用或受热熔化
1.下列叙述中,正确的是( )
A.从溶于某某或熔化状态下能否导电的角
度说,物质分为电解质和非电解质
B.只有酸、碱、盐类物质才属于电解质
C.氯化钠溶液在电流作用下电离为钠离子
与氯离子
D.电解质未必能导电,能导电的也未必是
电解质
D
【当堂检测】
2.下列叙述正确的是( )
A.某纯净物不是电解质,就是非电解质
B.溶于某某能电离出氢离子的化合物一定是酸
C.硫酸钡难溶于某某,但硫酸钡属于电解质
D.CO2的水溶液能导电,所以CO2是电解质
C
3.下列状态时,能导电的电解质是( )
液态氯化氢 B. 熔融食盐
C. 胆矾晶体 D. 食用醋
4.下列物质中,导电性最差的是( )。
A.熔融氢氧化钠 B.石墨棒
C.盐酸 D.固态氯化钠
B
D
5.下列电离方程式错误的是( )。
A.NaHCO3==Na++H++CO32-
B.NaHSO4(溶液)==Na++H++SO42-
C.MgCl2==Mg2++2Cl— D.Ba(OH)2==Ba2++2OH-
A
6.下列物质能导电的有_______,属于电解质的有_______,属于非电解质的有
_______。
①熔融的氯化钠 ② KNO3溶液③碳酸钙固体 ④石墨⑤乙醇溶液⑥ 蔗糖
①②④
①③
⑥
二、填空题
1、 下列物质属于电解质的是 ;属于非电解质的是 ;能导电的物质是 ;其水溶液能够导电的物质 。
①氨水 ②蔗糖 ③烧碱 ④NH3XXXXXH2O
⑤CO2 ⑥碳酸钙 ⑦CH3COOH ⑧铜
⑨NaCl溶液 ⑩石墨
2、略*
3、请判断正误,并分析原因
①HCl的水溶液导电,但液态的HCl不导电。
②导电性强的溶液,自由移动的粒子数目一定多
③电解质在固态时不导电,在固态时导电的物质一定不是电解质
XXXXX
√
√
③④⑥⑦
②⑤
①⑧⑨⑩
①③④⑤⑦⑨
再见[全文已结束,注意以上仅为全文的文字预览,不包含图片和表格以及排版]
以上为《1-1-1-7电解质和非电解质》的无排版文字预览,完整格式请下载
下载前请仔细阅读上面文字预览以及下方图片预览。图片预览是什么样的,下载的文档就是什么样的。
图片预览